核準日期:2006年12月30日
修改日期:
2010年01月26日?????????? 發明專利? 專利號:ZL2012 1 0018074.9
2013年03月18日?????????? 發明專利? 專利號:ZL2012 1 0018812.X
2018年03月27日
匹多莫德口服溶液說明書
請仔細閱讀說明書并在醫師指導下使用
【藥品名稱】
通用名稱:匹多莫德口服溶液
商品名稱:芙露飲
英文名稱:Pidotimod Oral Solution
漢語拼音:Piduomode Koufu Rongye
【成份】
本品主要成份為:匹多莫德。
其化學名稱為:(R)-3-[(S)-(5-氧-2-吡咯烷基)羰基]-噻唑烷-4-羧酸。
其化學結構式為:
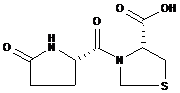
分子式:C9H12N2O4S
分子量:244.26
【性狀】本品為無色或微黃色的澄明液體,無臭,味微甜酸。
【適應癥】用于慢性或反復發作的呼吸道感染和尿路感染的輔助治療。
【規格】(1)10ml:0.2g??? (2)10ml:0.4g
【用法用量】
口服給藥。
3歲及以上兒童及青少年:每次0.4g,每日兩次,不超過60天。
成人:每次0.8g,每日兩次,不超過60天。
【不良反應】上市后監測和文獻資料可觀察到以下不良反應:
1. 消化系統損害:偶見惡心、嘔吐、腹瀉、腹痛、胃部不適、口干、腹脹、食欲異常、胃灼熱等,罕見肝臟氨基轉移酶升高等;
2. 皮膚及其附件損害:偶見可致皮膚過敏(包括皮疹和瘙癢)、皮膚潮紅等;嚴重者可罕見皮膚、粘膜潰瘍;
3. 神經系統損害:偶見頭暈、頭痛、眩暈等;
4. 其他:偶見胸悶、發熱、嗜睡、心悸、面部水腫、唇部水腫等,罕見過敏性紫癜、過敏性休克等。
【禁忌】1. 對本品過敏者禁用。2. 3歲以下兒童禁用。3. 妊娠3個月內婦女禁用。4. 遺傳性果糖不耐受,葡萄糖-半乳糖吸收不良患者禁用。
【注意事項】1. 用藥前應仔細詢問患者用藥史和過敏史,過敏體質患者慎用。2. 先天性免疫缺陷(高IgE綜合征)患者慎用。3. 由于食物會干擾本品的吸收,須空腹服用。4. 使用本品期間,如出現任何不良事件和/或不良反應,請咨詢醫生。
【孕婦及哺乳期婦女用藥】尚未有孕婦和哺乳婦女用藥方面資料。盡管動物實驗無生殖毒性,仍不宜用。妊娠3個月內婦女禁用。
【兒童用藥】本品可用于3歲及以上兒童及青少年患者,詳見【用法用量】。3歲以下兒童禁用。
【老年用藥】未進行該項實驗且無可靠參考文獻。
【藥物相互作用】藥物可能影響抑制或誘導淋巴細胞功能活性,或影響免疫系統活性的藥物的效力。
【藥物過量】尚未有使用本品藥物過量的報道,如遇藥物過量,則需用常規方法如催吐、導瀉、輸液等促進過量藥物排出。
【藥理毒理】
藥理作用:本品是一種人工合成的口服免疫刺激劑,通過刺激和調節細胞介導的免疫反應而起作用。
毒理研究:重復給藥毒性:大鼠連續52周灌服本品200、400、800mg/kg/日,中、高劑量組雌性動物體重明顯增加,800mg/kg/日(按體表面積折算,相當于臨床推薦最大劑量的4.9倍)組動物尿pH值和尿蛋白增高,組織學檢查可見高劑量組雄性動物頸淋巴結外皮層細胞增加,少數雌性動物胃、十二指腸膨大部分粘膜增生,可能與給藥有關。大鼠連續4周灌服本品1200mg/kg/日(按體表面積折算,相當于臨床推薦最大劑量的7.3倍),可引起少數動物腹瀉、鎮靜、反應性降低、活動減少和甲狀腺輕度增大,但無組織學改變。Beagle犬連續52周灌服本品,劑量達600mg/kg/日(按體表面積折算,相當于臨床推薦最大劑量的12.2倍)時,偶見少數動物腹瀉、腎臟重量增加、腎小管輕微擴張和間質纖維增生,血清尿素氮和肌酐輕微增加。
遺傳毒性:本品A mes試驗、L5178Y細胞基因突變試驗、CHO細胞染色體畸變試驗、哺乳動物Hela S3細胞DNA損傷試驗和小鼠微核試驗結果均為陰性。
生殖毒性:一般生殖毒性:雌、雄SD大鼠經口給予本品劑量達600mg/kg/日(按體表面積折算,相當于臨床推薦最大劑量的3.6倍),對生殖力無影響,對F1和F2代仔鼠的生育力、軀體運動、行為和神經發育也無影響。
致畸敏感期毒性:致畸敏感期雌性SD大鼠灌服劑量達600mg/kg/日時,未見致畸性;靜注250、500和1000mg/kg/日時,母鼠的攝食量減少、體重增加減慢。中、高劑量組動物著床率下降,但對胚胎發育無明顯影響,無毒性反應劑量為250mg/kg/日(按體表面積折算,相當于臨床推薦日注射量的12.2倍)。新西蘭兔在致畸敏感期灌服劑量達300mg/kg/日、靜注劑量達500mg/kg/日,均未見致畸性。
圍產期毒性:SD大鼠從妊娠第16天至產后第21天連續灌服劑量達600mg/kg/日、靜注劑量達500mg/kg/日,對母鼠的一般狀況、生育情況、F1代子鼠的存活、生長發育等均無影響。
【藥代動力學】
本品口服吸收迅速,人體口服生物利用度為45%,半衰期為4小時,以原型(靜脈給藥劑量的95%)經尿液排泄。與禁食狀態下給藥相比,與食物同時口服時,生物利用度降低50%,血漿濃度達到最大值時晚2小時。
本品完全經尿液排出,腎功能不全者消除半衰期延長。嚴重的腎功能不全(血漿肌酐濃度5mg/dl),匹多莫德的消除半衰期不超過8?9小時。尚未進行肝功能不全患者的研究,因為本品幾乎完全以原型經尿液排泄。
【貯藏】密封,在陰涼處(不超過20℃)保存。
【有效期】24個月
【包裝】
低硼硅玻璃管制口服液體瓶(棕色),
(1)10ml:0.2g? 10ml/支×6支/盒或8支/盒或10支/盒或12支/盒;
(2)10ml:0.4g? 10ml/支×6支/盒或8支/盒或10支/盒或12支/盒,20ml/支×6支/盒。
鈉鈣玻璃管制口服液體瓶(棕色),
10ml:0.4g? ?10ml/支×6支/盒或8支/盒或10支/盒或12支/盒,20ml/支×6支/盒。
【執行標準】國家食品藥品監督管理總局國家藥品標準WS-981(X-735)-2002-2014Z
【批準文號】(1)10ml:0.2g? 國藥準字H20030464??? (2)10ml:0.4g? 國藥準字H20030463
【上市許可持有人】企業名稱:江蘇吳中醫藥集團有限公司蘇州制藥廠
注冊地址:蘇州市吳中區東吳南路2-1號
【生產企業】
企業名稱:江蘇吳中醫藥集團有限公司蘇州制藥廠
生產地址:蘇州市吳中區東吳南路2-1號
郵政編碼:215168
電話號碼:0512-65256080? 65251551
傳真號碼:0512-66262681
網??? 址:http://www.tjguangda.com




